果汁通电:将应用电分析化学融入本科课程
第1部分 讲师手册
1 化学品、溶液和电极清单
- L-抗坏血酸 (99%) (Sigma-Aldrich - 美国, CAS号: 50-81-7)
- 氯化钾 (KCl) (99-100%) (Sigma-Aldrich - 美国, CAS号: 7447-40-7)
- 蒸馏水;
- 0.1 M KCl溶液;
- 玻碳电极(直径3.0 mm)(BASi Research Products - 美国)
- 铂丝 (99.95%) (长6.0-8.0 cm;直径0.05 mm) (Strem Chemicals - 美国, CAS号: 7440-06-4)
- 银/氯化银准参比电极 (Ag/AgCl) *
- 氧化铝抛光粉 () (1 μm 粒径) (Buehler - 美国)
- 氧化铝抛光粉 () (0.3 μm 粒径) (Buehler - 美国)
- 氧化铝抛光粉 () (0.05 μm 粒径) (Buehler - 美国)
注:
*由讲师预先制备。制备步骤在下一节中描述。
2 玻璃仪器和材料清单
- 100 mL 容量瓶
- 称量瓶
- 量筒和容量移液管
- 玻璃巴斯德吸管
- 带三个孔的塑料盖的20 mL玻璃小瓶*
- 抛光布 (MicroCloth) (压敏胶背衬) (Buehler - 美国)**
- CD光盘***
- 实验室支架和夹具
注:
*此项可用20 mL玻璃烧杯替代。如果没有塑料盖,学生可使用实验室封口膜 (Parafilm™) 来封闭小瓶。 *剪成5 cm X 5 cm的正方形。 CD光盘可作为方便的平台,用于粘贴三块抛光布(每种粒径各一块),以抛光玻碳电极。
3 设备清单
- Metrohm™ μStat300 恒电位仪,由DropView 8400软件控制*
- Microsoft Surface Go平板电脑*
- 分析天平
注:
*我们建议讲师预先测试所有电子设备。此外,讲师必须确保在活动前更新所有软件,以避免实验期间因软件和系统更新而造成延误。
 图S1:(A) 实验装置及主要所需材料(a-平板电脑,b-便携式恒电位仪,c-参比电极、工作电极和对电极,d-1.0、0.3和0.05 μm 氧化铝粉,e-电化学池,f-抛光垫,g-KCl,h-0.1 M KCl溶液,i-AA,j-100 mL容量瓶,k-蒸馏水)。
图S1:(A) 实验装置及主要所需材料(a-平板电脑,b-便携式恒电位仪,c-参比电极、工作电极和对电极,d-1.0、0.3和0.05 μm 氧化铝粉,e-电化学池,f-抛光垫,g-KCl,h-0.1 M KCl溶液,i-AA,j-100 mL容量瓶,k-蒸馏水)。
4 Ag/AgCl准参比电极的制备
Ag/AgCl准参比电极由银丝制备,银丝先用细砂纸刮擦进行机械清洁。为了将AgCl以覆盖银丝的薄层形式进行电沉积,使用由0.1 M HCl和3 M KCl组成的溶液作为电解质。电解过程以银丝为阳极,铂丝为阴极进行。两个电极均连接到恒电位仪,电解通过施加 (a) 5 V 电压 1分钟,和 (b) 10 V 电压 10分钟来进行。每个电极上发生的电化学反应如下:
阳极 (+): 阴极 (-):
总反应:
如上述反应所示,铂丝上析出氢气表明该过程正在正确进行。经过所述处理后,应在银丝上观察到一层清晰的灰色/棕色AgCl沉积层。制备好的Ag/AgCl准参比电极在不使用时必须浸泡在3 M KCl溶液中储存。
5 典型结果
以下是讲师预先获得的代表性结果。
 图S2:(A) AA (12.0 mM) 在裸GCE上于0.10 M KCl溶液中的电化学行为,扫描速率为50 mV s⁻¹。(B) 在裸GCE上,随着AA浓度增加(0.06、0.12、0.18、0.23和0.30 mM),在50 mV s⁻¹扫描速率下获得的循环伏安图。(C) 分析曲线。(D) 橙汁、(E) 苹果汁和(F) 蔓越莓汁在0.1 M KCl (1:20) 中稀释后,于50 mV s⁻¹扫描速率下的循环伏安图。
图S2:(A) AA (12.0 mM) 在裸GCE上于0.10 M KCl溶液中的电化学行为,扫描速率为50 mV s⁻¹。(B) 在裸GCE上,随着AA浓度增加(0.06、0.12、0.18、0.23和0.30 mM),在50 mV s⁻¹扫描速率下获得的循环伏安图。(C) 分析曲线。(D) 橙汁、(E) 苹果汁和(F) 蔓越莓汁在0.1 M KCl (1:20) 中稀释后,于50 mV s⁻¹扫描速率下的循环伏安图。
本活动中使用的伏安法的准确度由讲师通过在掺有不同分析物浓度的0.1 M KCl溶液中进行AA测定来评估(每个浓度n=3)。结果以回收率百分比表示,并显示在表S1中。
表S1:在掺有不同抗坏血酸浓度的电解质样品中的准确度分析。
| 添加[AA] (M) | 测得[AA] (M) | 回收率 (%) | 平均回收率±SD (%) | RSD |
|---|---|---|---|---|
| 96.10 | 1.10 | |||
| 93.64 | ||||
| 95.56 | ||||
| 96.10 | 0.90 | |||
| 95.0 | ||||
| 94.00 | ||||
| 100.2 | 1.22 | |||
| 99.02 | ||||
| 97.24 |
6 故障排除
Q1. 伏安图有噪声或系统中无电流通过
可能解决方案:重新连接所有电缆到工作电极、参比电极和对电极,确保所有连接都已正确建立且不松动。确认所有连接器(鳄鱼夹)是干燥的,没有湿。确认电极在支持电解质中没有相互接触。如果噪声仍然存在,重启所有设备,并重新记录伏安图。
Q2. 峰不出现或峰形不佳
可能解决方案:重新抛光GCE,确保其表面光亮如镜。用足量的蒸馏水彻底冲洗电极表面。
Q3. 氧化峰发生偏移
可能解决方案:如果氧化峰在工作电位窗口(-0.1 V至+0.5 V)内向更低或更高的电位值移动,请检查溶液的pH值。过酸的溶液会导致峰向更正的电位移动,而碱性溶液会导致峰向更低的电位移动。如果确认是pH问题,我们建议重新配制0.1 M KCl溶液,并储存在已彻底清洗、无酸性或碱性残留物的容器中。重要的是,确保蒸馏水未被酸性或碱性废物污染。理想情况下,0.1 M KCl的pH值应接近中性(6.5-7.5)。
Q4. 软件无法识别恒电位仪
可能解决方案:关闭软件窗口,重启恒电位仪,然后将仪器重新连接到平板电脑。如果问题仍然存在,检查USB-C连接器是否工作正常且无缺陷。如果确认是此问题,更换电缆和连接器,然后重新连接设备。
第2部分 提供给学生的实验手册
目标:测定未知果汁样品中抗坏血酸的浓度。
1 原理与反应:
抗坏血酸,广为人知的维生素C,是一种基础营养素和高效抗氧化剂,也广泛用作食品添加剂。准确高效地测定并标注食品或药品中抗坏血酸的含量至关重要。因此,食品工业的质量控制需要抗坏血酸的测定方法。这些方法大多依赖于抗坏血酸氧化为脱氢抗坏血酸,如下所示:
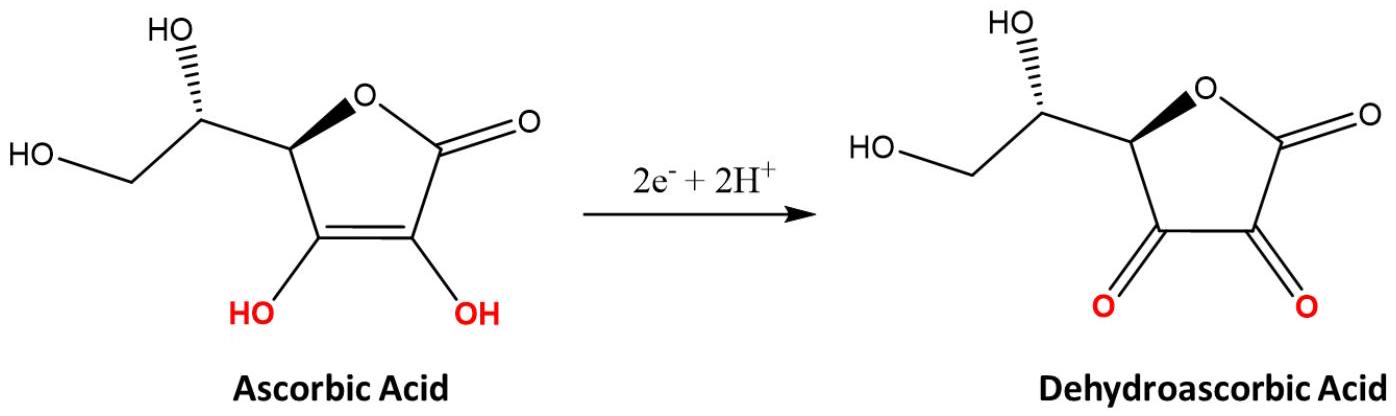
本实验的目标是基于抗坏血酸在宏电极上的电化学氧化来对其进行定量。循环伏安法是研究抗坏血酸****电化学行为的标准电化学技术。本实验将采用此方法测定未知样品中的抗坏血酸浓度。
2 溶液配制:
抗坏血酸标准储备溶液的配制: (i) 使用分析天平(注意小数位数!),在称量瓶中称取约0.2克抗坏血酸。 (ii) 将抗坏血酸科学地转移到一个100 mL容量瓶中。冲洗称量瓶,用0.1 M KCl定容并充分混合。注意,抗坏血酸的纯度标注在容器标签上,请计算您储备溶液的精确浓度。
抗坏血酸工作溶液的配制: (iii) 用移液管吸取10.00 mL的抗坏血酸储备溶液到一个100 mL容量瓶中,并用0.1 M KCl稀释至刻度线。
此溶液称为抗坏血酸工作溶液。
3 分析:
3.1 化学可逆性的测定
(iv) 按照所提供视频的演示,将恒电位仪μStat 300 (Metrohm)与平板电脑连接。 (v) 将电化学池与μStat 300连接。 (vi) 使用提供的抛光垫,依次用1.0 μm、0.3 μm和0.05 μm粒度的氧化铝粉抛光玻碳(GC)工作电极。 (vii) 将足量的抗坏血酸工作溶液转移到电化学池中,并将GC电极(红线)、Pt对电极(黑线)和参比电极(蓝线)放入小瓶中。 (viii) 在初始电位为-0.10 V,最终电位为+0.50 V,扫描速率()为50 mV/s的条件下记录伏安图。 在报告中陈述您对该电化学过程化学可逆性的观察。
3.2 校准曲线
(ix) 使用量筒移液管,将5.00 mL、10.00 mL、15.00 mL、20.00 mL和25.00 mL的抗坏血酸工作溶液分别加入五个100 mL的容量瓶中。 (x) 用0.1 M KCl定容并充分混合。 (xi) 在以下条件下,为每种溶液在电化学池中记录一张伏安图: 初始电位: -0.10 V 最终电位: +0.50 V 扫描速率: 50 mV/s
在进行下一个样品测量前,请按照在线视频的演示保存每个数据集。
(xii) 在相同条件下,记录一张0.1 M KCl的伏安图。这将是您的空白。 (xiii) 使用任意计算机软件,绘制峰电流(最大电流)对抗坏血酸浓度的图,并得到一张校准图。(请记住,在您样品的峰电位处,从每个测量的CVs峰电流中减去空白电流。空白电流必须总是对应于CVs中观察到的峰电位。)
3.3 未知样品中抗坏血酸浓度的测定 (xiv) 使用移液管,将5.00 mL的未知样品加入一个100 mL容量瓶中。用0.1 M KCl定容并充分混合。 (xv) 在以下条件下记录未知溶液的伏安图: 初始电位: -0.10 V 最终电位: +0.50 V
扫描速率: 50 mV/s
注意:重复此步骤3到5次。在采集每个伏安图前,冲洗并抛光GC电极。
(xvi) 测定未知样品的峰电流,并使用校准曲线确定未知溶液中存在的抗坏血酸浓度。
4 计算:
在之前的实验中,我们引导您完成了所有的计算步骤和公式。在这里,您应该自己理解如何从校准曲线计算出您的最终结果。思考峰电流和抗坏血酸浓度之间的关系。
所有学生在离开实验室时都应理解如何进行计算。如果您找不到正确的路径,请在离开实验室前与助教、博士后和讲师讨论实验的这一方面。
第3部分 评分标准
| 项目 | 分数 | 说明 |
|---|---|---|
| 预实验流程 | 1 | 此分数根据学生在实验前准备实验笔记本的情况给出。 |
| 实验室安全与态度 | 1 | 如果学生持续摘下护目镜、实验服等,则扣除此分数。 |
| 循环伏安图 | 2 | 根据CVs的规范性评分(标题或图注、坐标轴标签、显示数据点等)<br> 请注意,CVs的分数可以根据这是否是学生首次接触循环伏安法进行调整 |
| 计算 | 3 | 根据有效数字、稀释计算(标准品和未知样品的)、标准偏差、使用校准曲线进行计算、Grubbs检验剔除异常值等进行评分 |
| 准确度 | 8 | 最终值与讲师预先测定的结果进行比较。学生的数值应重新计算以排除计算错误(因为学生不总能正确处理稀释),以免因计算错误而多次惩罚他们。 |
| 总分 | 15 |
第4部分 报告卡
| 实验:果汁中抗坏血酸的电分析测定 | |
|---|---|
| 学生姓名 | |
| 测定方法 | |
| 未知样品代码 | |
| 结果 (平均值±标准偏差) | |
| 小组 | |
| 日期 |